- トップ>
- 研究紹介 放射線生物研究
放射線生物グループは医学科放射線治療学教室では保健学科生体医用物理工学講座と合同で研究活動をしています。学生が多く研究室には活気があります。大阪大学医学部には照射装置を含め共同利用機器が豊富にあり、動物実験施設も利用でき充実した環境です。また、附属病院での臨床試料を用いた研究もできます。
放射線生物に興味のある方は一緒に研究しましょう。大学院生(修士、博士)を募集中です。
主な担当教員
放射線治療学: 玉利慶介、立川章太郎
保健学科: 高橋豊、皆巳和賢、勝木翔平
研究テーマ一覧
- 細胞外小胞が放射線感受性に与える影響(玉利)
- 血液中の成分から放射線感受性に影響する因子に関する解析(玉利)
- 放射線照射による細胞応答解析(皆巳)
- Clonal Hematopoiesis (CH) と放射線治療の研究(立川)
- 細胞老化・染色体不安定性による放射線抵抗性獲得機序の研究(立川)
- RNAメチル化と膵癌の治療抵抗性に関する研究(立川、大阪大学 疾患データサイエンス学 石井教授との共同研究)
- 様々な放射線と免疫チェックポイント阻害剤を用いたアブスコパル効果の検討(勝木・高橋)
- 膵管癌の腫瘍内微小環境を考慮したモデルによる放射線応答の検討(勝木・高橋)
- 放射線照射後のがん抗原放出のモデル化(勝木・高橋)
- 免疫細胞に対する放射線の影響(勝木・高橋)
- 放射線治療とヒアルロン酸合成阻害剤の併用効果の検討(勝木・高橋)
- トリプルネガティブ乳がんの腫瘍内微小環境を模擬したモデルによる放射線応答の検討(勝木・高橋)
- ホウ素中性子捕捉療法(BNCT)の適応拡大を目指した寡分割照射の生物学的有用性の検討(勝木・高橋)
細胞外小胞が放射線感受性に与える影響
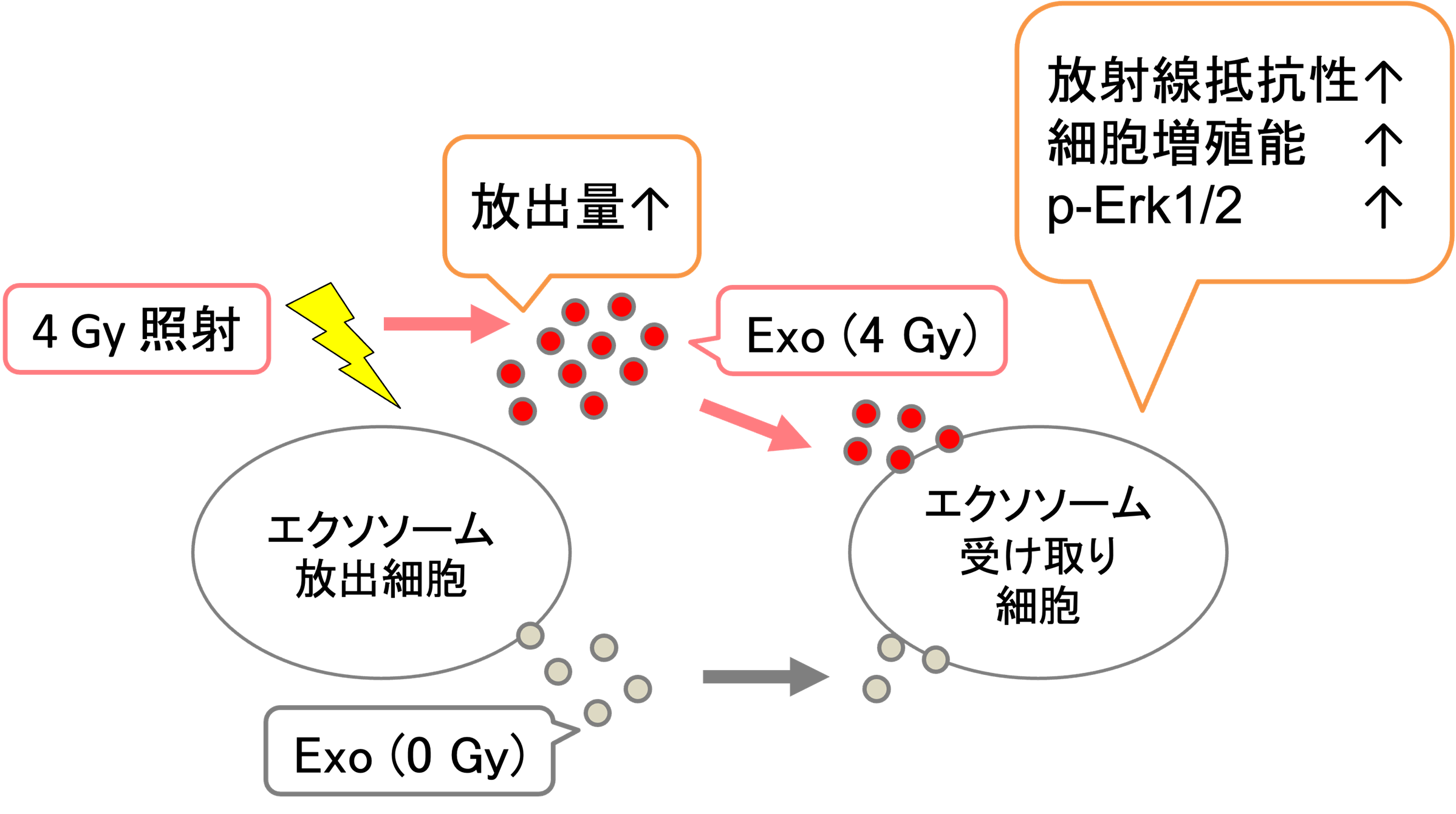
細胞外小胞は細胞から放出される脂質二重膜に包まれた生体物質を含んだ小胞で放出細胞から受け取り細胞の細胞間コミュニケーションに重要な役割をしていることが知られています。がん細胞に放射線照射をすると、細胞外小胞の産生が亢進し、受け取り細胞側では放射線抵抗性になるという現象について研究をしています(Cancer Genomics Proteomics. 2024)。
血液中の成分から放射線感受性に影響する因子に関する解析
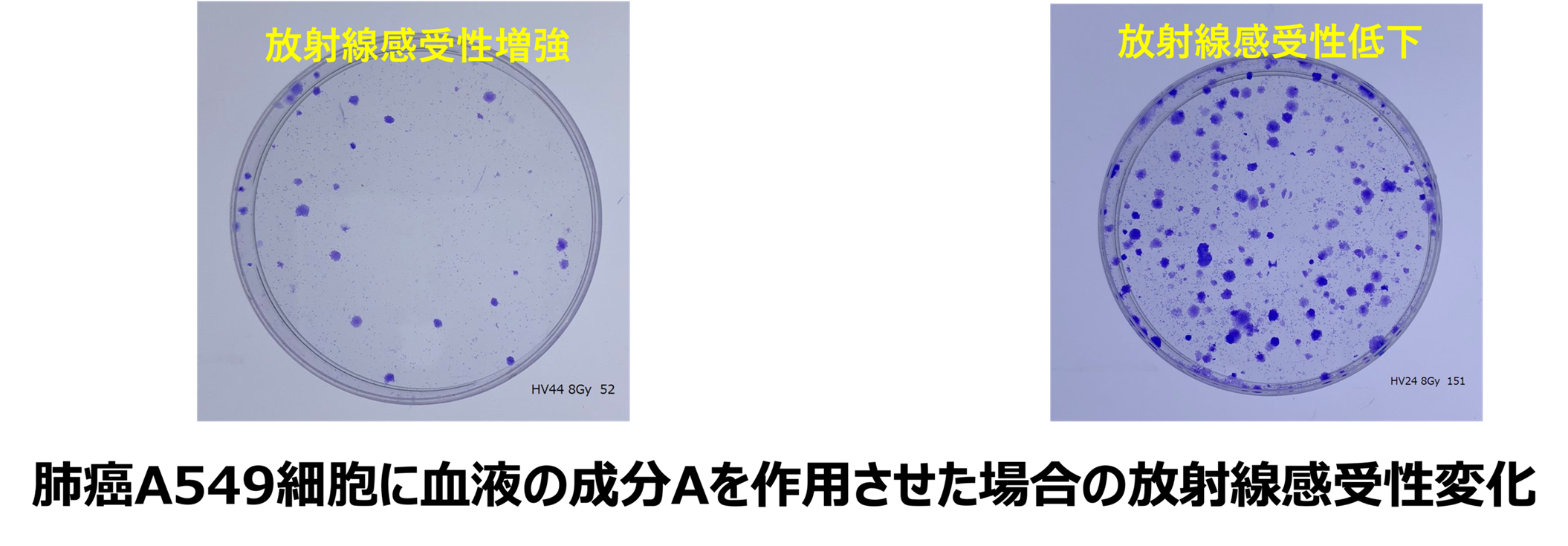
血中の成分を分析し、癌の放射線感受性に影響する因子を同定できれば、放射線感受性を予測する新しい検査法などを開発できる可能性があり、主に細胞外小胞などの検討を行っています。これまでに、エクソソーム上のPDL1が頭頸部癌の予後と相関したことを論文報告しています(Adv Radiat Oncol. 2024)。最近では血液のとある成分を抽出して細胞に作用させると細胞の放射線感受性が変わるというような研究もしています。
放射線照射による細胞応答解析
がん治療において、がんの「遠隔転移」の制御は大変重要なテーマとなっています。大阪大学は、さまざまな施設と協力体制を築いており、X線・電子線・陽子線・炭素イオン線と放射線治療に用いられる線質を全て使用できる世界的に見ても貴重な研究環境です。本研究室では、放射線照射後の細胞の振る舞いについて、細胞死以外にも放射線照射後に生存した細胞の運動能や遊走能、浸潤能について、上記の線質の違いについて解析しています。

上記の免疫染色の画像は、X線と炭素イオン線を同程度の殺細胞効果がある線量を照射した後の細胞運動の様子です。X線を照射された細胞は照射3時間後では、既に細胞運動をスペースに向かって始めていることが分かります(矢印が運動細胞を指しています)。一方、炭素イオン線を照射された細胞は、運動を6時間以上経っても始めることがありません。この様に、線質によって生き残ったがん細胞の振る舞いが異なることを突き止めました。

さらに分子メカニズムを解析すると、核膜貫通型タンパク質であり、細胞骨格や細胞接着と関連のある分子であるSUNに放射線が影響を与えており、この結果、細胞接着や細胞運動に関連するシグナル経路に影響することを見出しました。
上記の様な基礎研究を通じて、適切な放射線治療を行う為の知見を集めています。
Clonal Hematopoiesis (CH) と放射線治療の研究
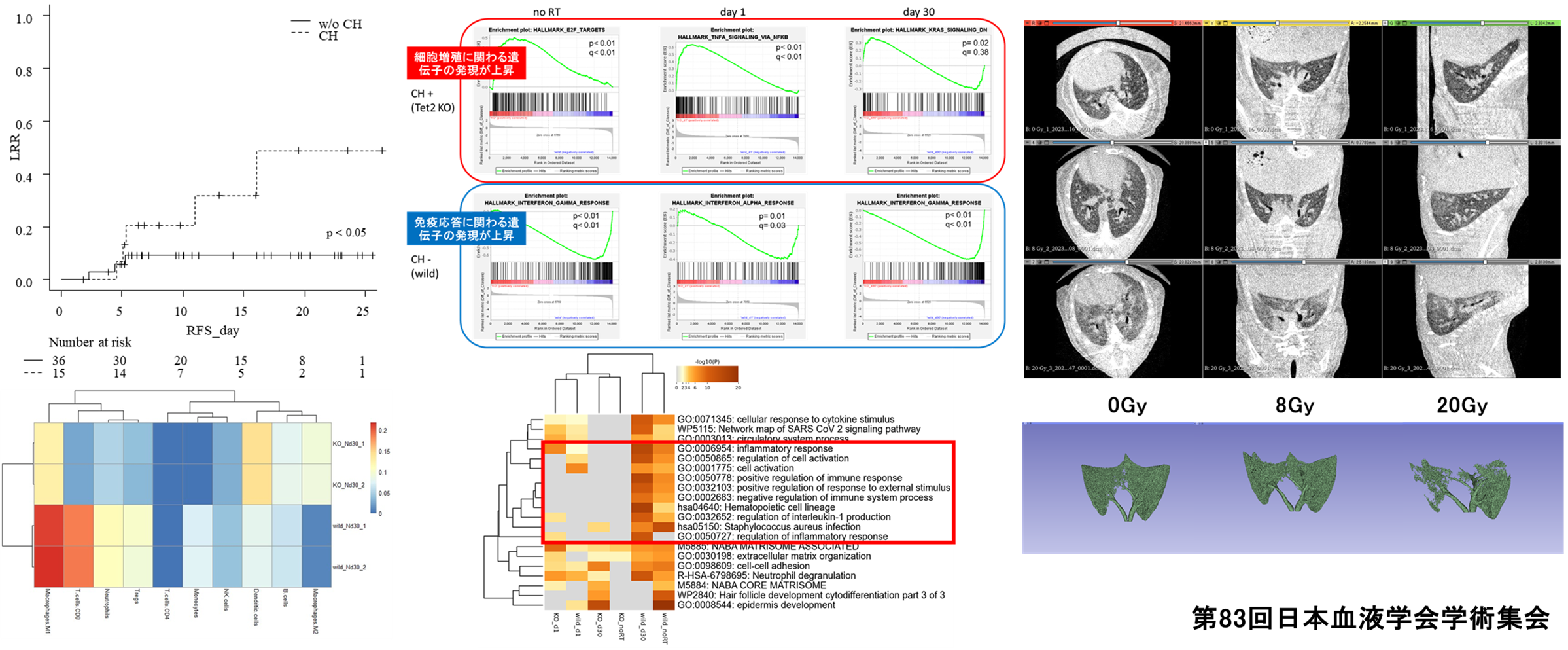
クローン性造血(Clonal Hematopoiesis, CH)は、加齢に伴い血液細胞に蓄積する遺伝子変異現象を指します。近年の研究で、CH保有者は悪性腫瘍の発症リスクが上昇すること、さらに担癌患者の生存率に影響を及ぼすことが明らかになりました。我々の研究でCHが放射線治療抵抗性に関わることが判明し、現在は治療抵抗性を誘導する分子メカニズムの解明と、放射線肺臓炎をはじめとする治療関連合併症との関連性について研究を進めています。
細胞老化・染色体不安定性による放射線抵抗性獲得機序の研究
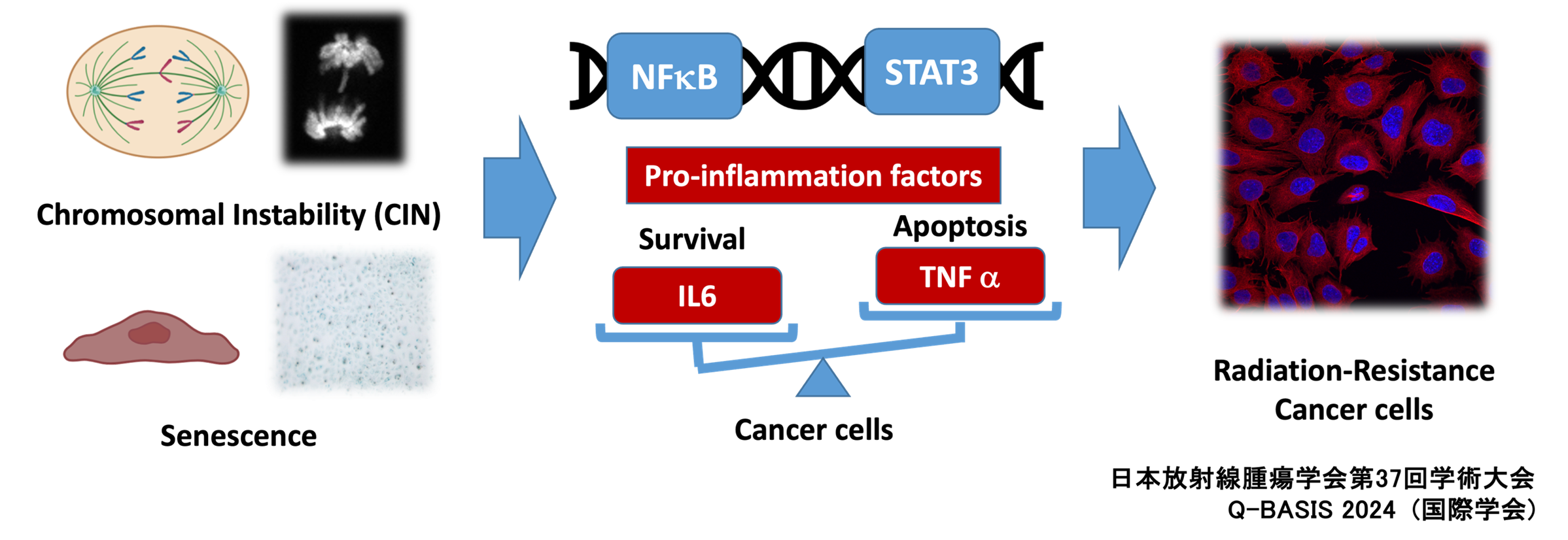
細胞老化は生体の恒常性維持において重要な役割を果たしており、近年、放射線応答との関連性が注目されています。我々の研究では、放射線治療に対する抵抗性獲得メカニズムの一つとして、細胞老化に随伴する慢性炎症反応(SASP: Senescence-Associated Secretory Phenotype)の関与を見出しました。今後は、放射線抵抗性を獲得した腫瘍の分子生物学的特性を包括的に解析し、細胞老化を標的とした新規治療戦略の確立を目指していきます。
RNAメチル化と膵癌の治療抵抗性に関する研究
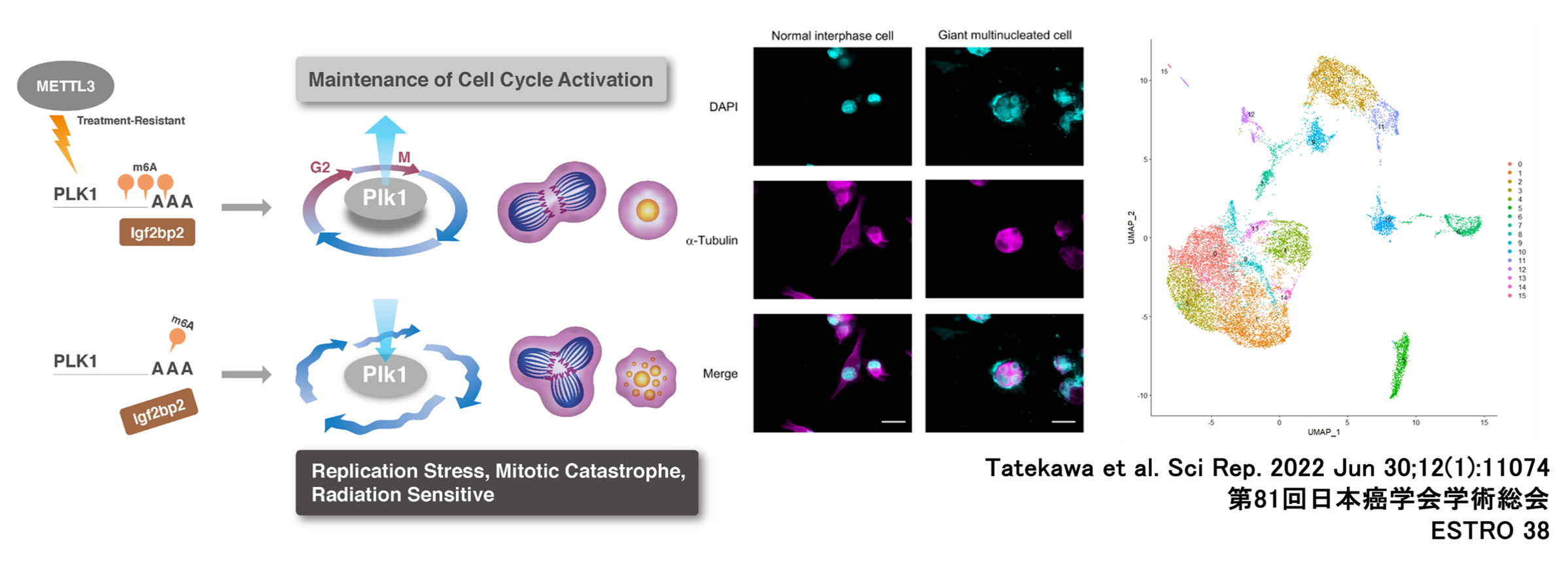
N6-メチルアデノシン(m6A)は、最も一般的なRNA修飾であり、METTL3-METTL14複合体により制御されています。膵癌においては、METTL3の発現上昇が腫瘍増殖、転移、治療抵抗性の獲得に関与することが明らかになっています。今後は、RNA修飾を標的とした新規治療法の開発や、治療効果予測のためのバイオマーカーの同定を目指した研究を進めていきます。
様々な放射線と免疫チェックポイント阻害剤を用いたアブスコパル効果の検討
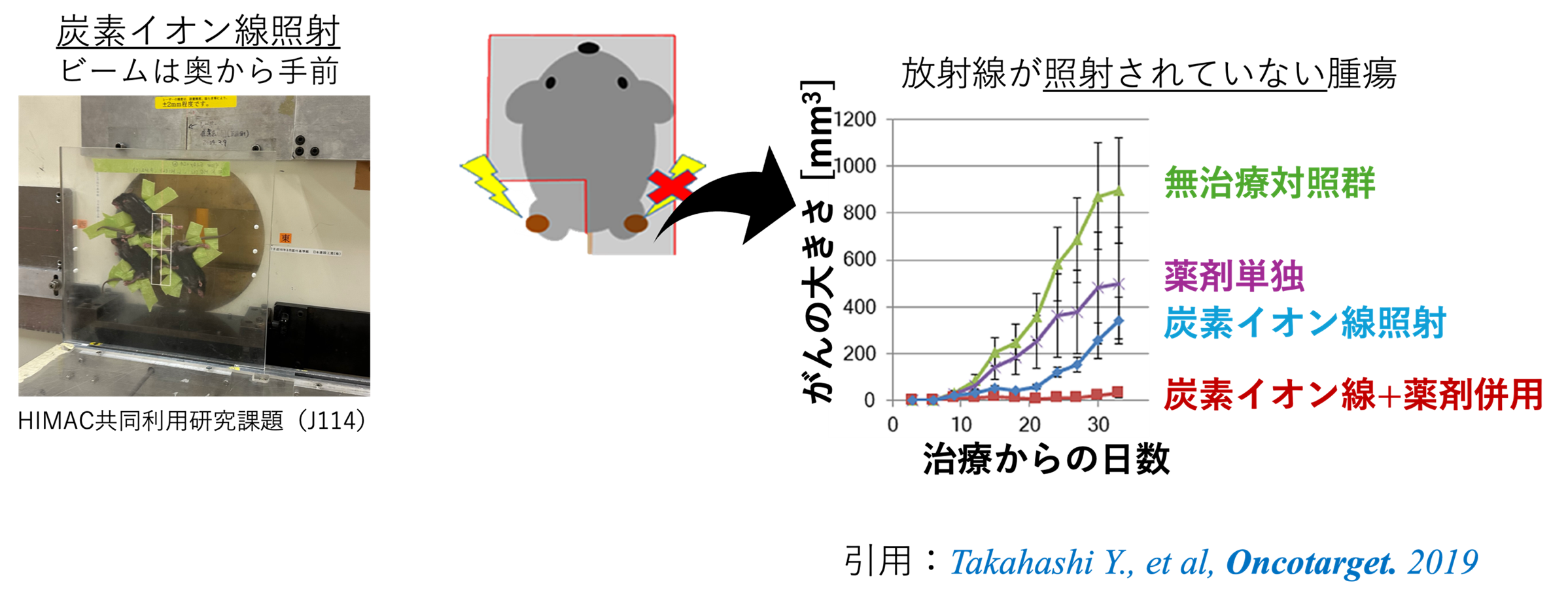
マウスに対して炭素イオン線+免疫チェックポイント阻害剤の併用治療による治療効果を評価し照射されていないがんまでにも治療効果が得られたこと(アブスコパル効果)を示しました。現在は、他のがん種についてもこの併用治療の効果を検討しておりアブスコパル効果のメカニズムの解明を目指した研究を行っています。今後は兵庫県粒子線医療センターとの共同研究で陽子線での検討も行う予定です。
膵管癌の腫瘍内微小環境を考慮したモデルによる放射線応答の検討
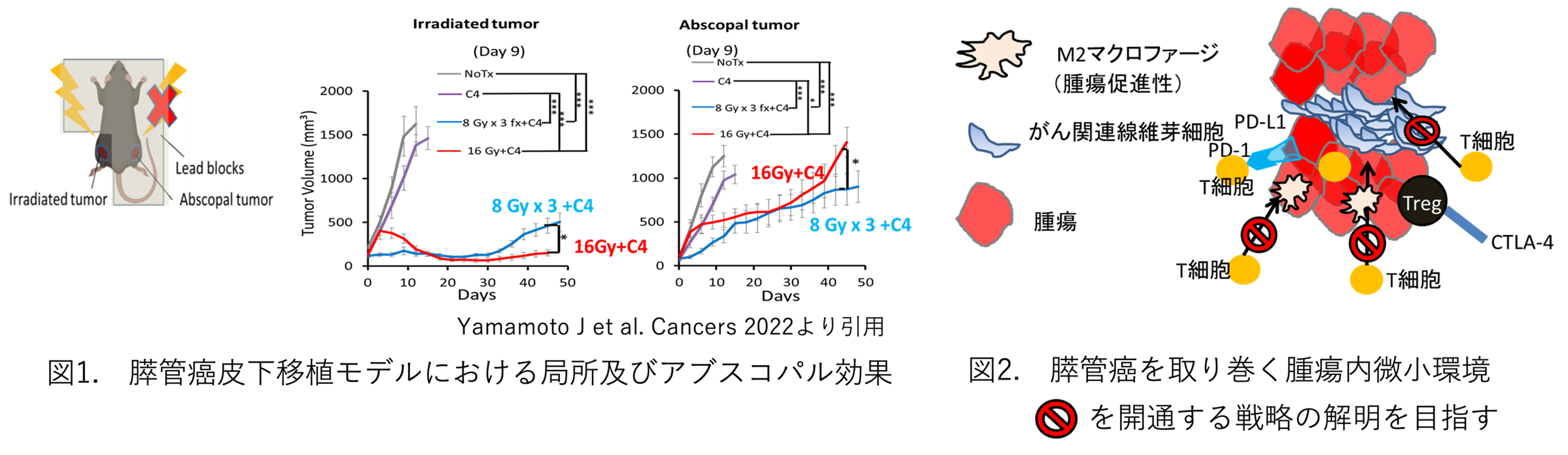
私たちは、これまでにマウス膵管癌の皮下移植モデルを用い、放射線と免疫チェックポイント阻害剤(C4: 抗CTLA-4抗体)の併用により、局所効果の増強に加え、非照射腫瘍の増殖を抑制すること(図1)、高線量放射線照射により、細胞傷害性免疫細胞の浸潤が増加することを明らかにしました(Yamamoto et al Cancers, 2022)。膵管癌は、間質が多く、免疫細胞が到達しにくい環境にあります。特にがん関連線維芽細胞 (CAF)は、免疫細胞の腫瘍への浸潤を妨げるとともに、放射線感受性にも影響を及ぼしている可能性があります(図2)。現在、様々な方法でCAFを誘導し、皮下移植モデルをより臨床に近い膵管癌の腫瘍内微小環境を模擬したモデルの構築を行っています。このモデルを用いることで、放射線応答や放射線腫瘍免疫応答を検討し、臨床への橋渡しを目指しています。また、骨肉腫の下腿骨への同所移植による検討も行っています。
放射線照射後のがん抗原放出のモデル化
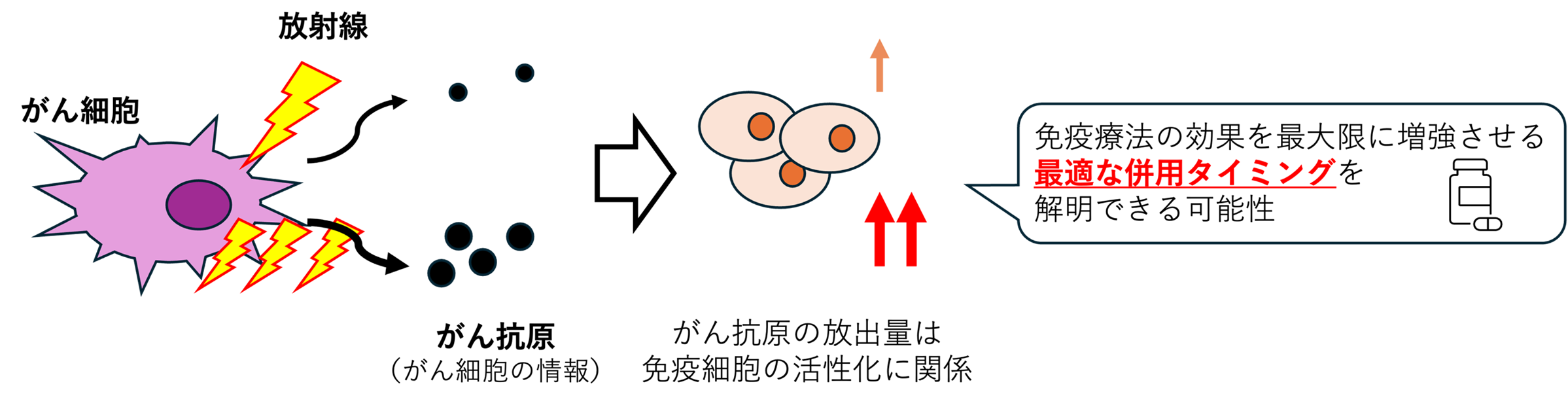
がんに対する免疫機能が活性化するために重要な、がん細胞の情報(がん抗原)の放出を検討しています。放射線照射後のがん細胞からのがん抗原の放出を詳細に明らかにすることでがんに対する免疫機能を高めるための放射線治療法の提案を目指しています。
免疫細胞に対する放射線の影響

放射線はがん免疫機能を高められますが、一方で免疫細胞は放射線に非常に弱いとされ、放射線治療後のリンパ球減少症はがん患者さんの予後に影響を与えることが報告されています。放射線によってリンパ球など免疫細胞にどのような変化が生じるのか、細胞死以外の観点も含めて検討しています。生体内で混在している免疫細胞を分別して取得し、放射線照射実験により免疫細胞の種類ごとに対する放射線の影響を多角的に解析し、がん治療時に免疫機能を最大限にする放射線治療方法の提案を目指しています。
放射線治療とヒアルロン酸合成阻害剤の併用効果の検討
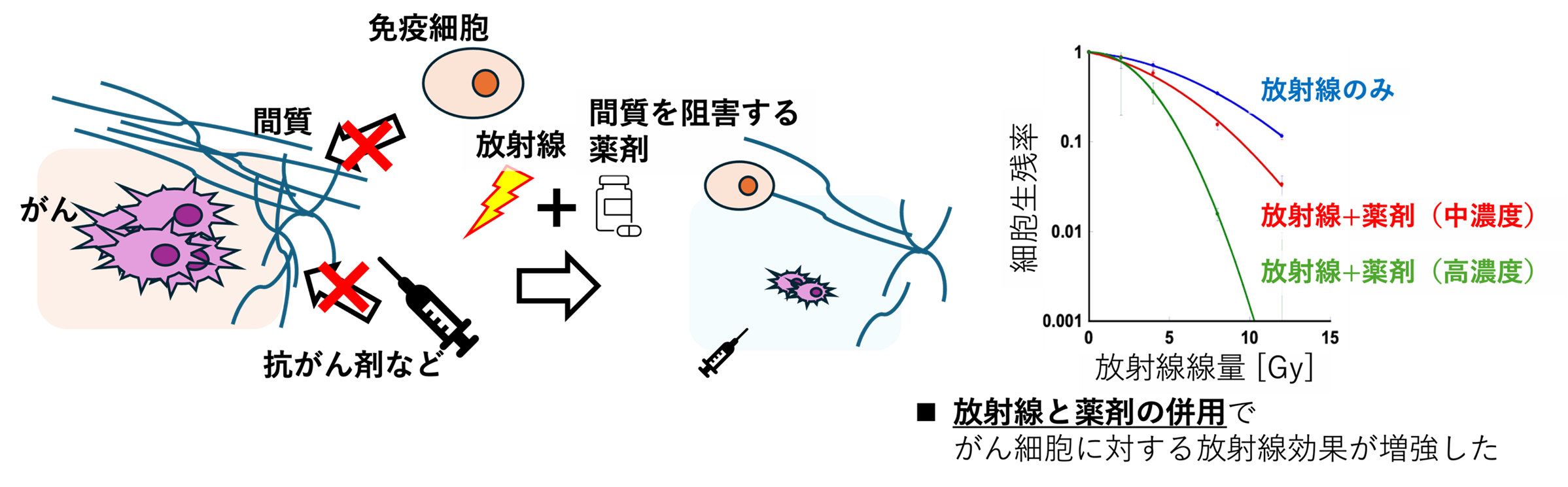
がんは周囲に間質と呼ばれる組織を構成し、免疫細胞や薬剤が入っていけないがんの成長にとって有利な環境を作ります。間質の主成分を阻害する薬剤と放射線照射で、免疫細胞や抗がん剤などが入れる環境に作り変え、放射線治療の効果の増強を目指して研究しています。
トリプルネガティブ乳がんの腫瘍内微小環境を模擬したモデルによる放射線応答の検討
乳癌は、女性における部位別の罹患率、死亡率が最も高いがんです。特に、ホルモン受容体やHER2陰性のトリプルネガティブ乳癌(TNBC)は、化学療法、手術、放射線治療を行っても再発や転移をきたすことも少なくありません。このような治療抵抗性を示すTNBCに対する有効な治療法は未だ十分に解明されていません。
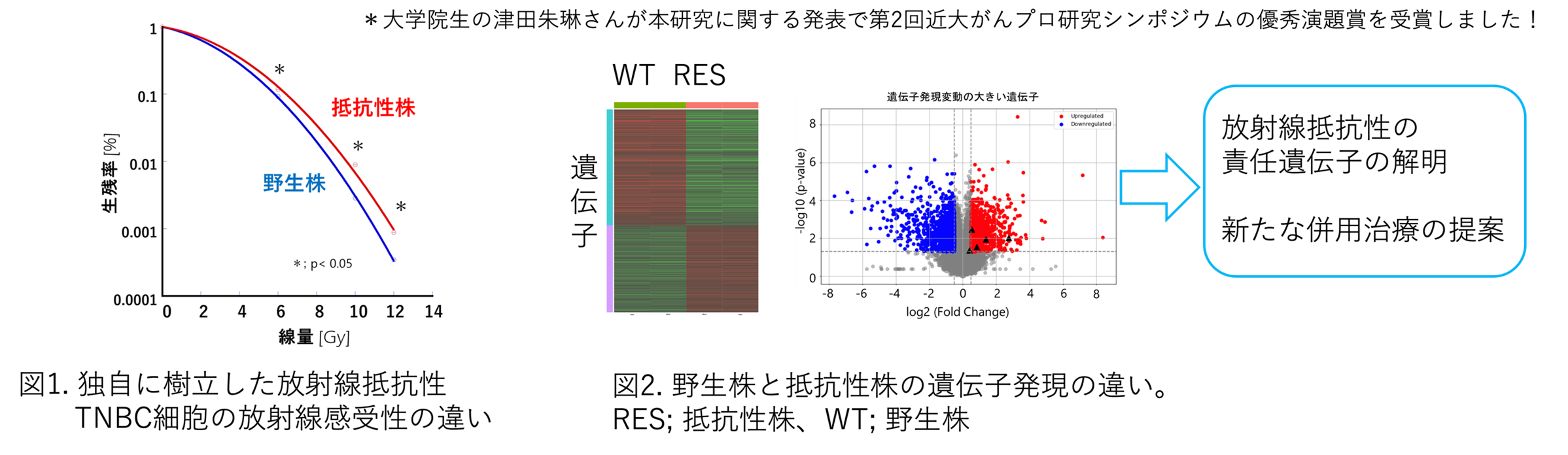
私たちは、独自に放射線抵抗性TNBC細胞株を樹立し(図1)、 RNAシーケンスにより、野生株との遺伝子群の相違を解析することで、放射線耐性機序の解明を試みています。
これまでに、放射線抵抗性に関連するいくつかの遺伝子群に有意な違いがあることが分かりつつあります(図2)。本研究により、放射線抵抗性を解除する標的を見出すとともに、新しい併用治療の提案を目指します。
ホウ素中性子捕捉療法(BNCT)の適応拡大を目指した寡分割照射の生物学的有用性の検討
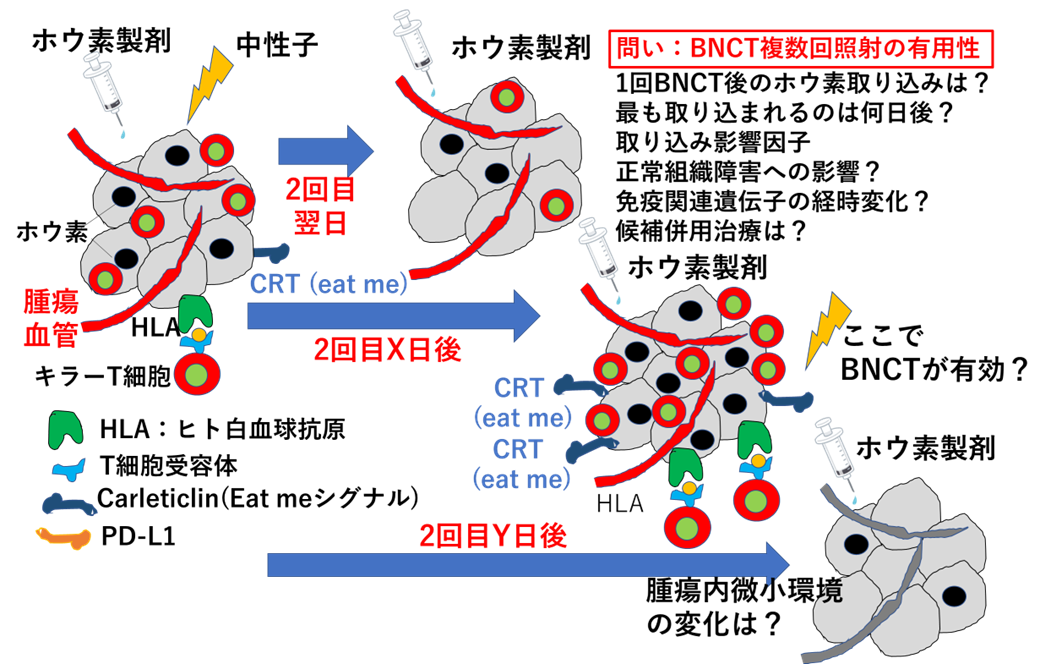
BNCTは、ホウ素製剤を取り込ませた腫瘍に中性子を照射することで発生する、飛程の小さいα線やLi粒子により腫瘍に大線量を照射する方法です。BNCTは、世界に先駆けて切除不能又は再発頭頸部腫瘍に対し薬事承認をされました。今後適応拡大が期待されます。
中性子は深部へ到達しにくいため、深部腫瘍に適応拡大するためには分割照射が望まれます。しかし、BNCTの分割照射の生物学的効果は十分に解明されていません。私たちは、BNCTにおける最適な分割照射レジメンを明らかにするとともに、最適な併用治療を探索する研究を始めています。本研究は、国立がん研究センター中央病院放射線治療科との共同研究です。
 臨床研究
臨床研究 医学物理研究
医学物理研究 放射線生物研究
放射線生物研究 多施設共同研究
多施設共同研究